Il est vrai que l’expression de protéines dans E. coli est bien établie et largement utilisée. La capacité de ce système bactérien à produire de grandes quantités de protéines en un temps relativement limité est avantageuse, notamment en comparaison d’autres systèmes d’expression, comme les systèmes eucaryotes pour lesquels 3 ou 4 semaines sont nécessaires (sans compter le temps de développement de la lignée cellulaire utilisée) !
Deux jours seulement suffisent à produire une protéine dans un système cell-free !
Quant au système cell-free, utilisé aussi pour l’expression de protéines, il s’avère beaucoup plus rapide que le système in vivo E. coli. Ceci tient au fait que certaines étapes spécifiques à la production de la protéine d’intérêt ne sont pas requises ou sont raccourcies.
Tout d’abord, seulement un à deux jours suffisent pour produire et purifier une protéine in vitro avec un système cell-free, alors qu’il faut bien deux semaines, sans prendre en compte l’étape de biologie moléculaire, pour l’obtention d’une protéine dans un système Escherichia coli (Carlson et al. 2012).
Cette réduction du délai d’exécution est principalement due au gain de temps sur les étapes précédant l’expression des protéines ; étapes qui sont très réduites pour un système in vitro cell-free. En effet, à l’inverse du système E. coli, les systèmes acellulaires peuvent fonctionner à partir de fragments d’ADN linéaires, ce qui permet de s’affranchir du long processus de clonage, nécessaire pour générer un plasmide d’expression, ainsi que du processus de transformation et de sélection des bactéries recombinantes.
De plus, les travaux qui ont permis d’améliorer la stabilité des fragments d’acides nucléiques linéaires, se sont traduits par des niveaux de productivité rivalisant avec l’expression à partir de constructions plasmidiques (Rosenblum et al. 2014).
Par ailleurs, l’extrait cellulaire utilisé dans un système in vitro peut être préparé à l’avance et conservé jusqu’à un an sans que ses propriétés soient altérées (Zawada et al. 2011). Cette capacité à stocker l’extrait cellulaire pour un usage futur est un avantage majeur.
Le processus de production est alors très rapide car il ne nécessite que la décongélation de l’extrait cellulaire, l’ajout d’une matrice d’ADN et d’un mélange réactionnel. Seulement six à huit heures plus tard, la protéine d’intérêt est prête à être passée sur une colonne de purification ! Nous pouvons ainsi dire que le processus de synthèse de protéines dans un système cell-free est beaucoup plus rapide que dans un système E. coli, principalement par l’absence d’étape de pré-culture et d’amplification des cellules avant la phase d’expression (Carlson et al. 2012).
Enfin, comme la fraction récupérée est moins riche dans un système acellulaire, le schéma de purification est simplifié par rapport à un système E. coli. En effet, un processus en une ou deux étapes est requis dans le système cell-free, tandis que deux à trois étapes sont généralement nécessaires dans le système E. coli.
A titre d’exemple, Synthelis, utilise depuis plus de 10 ans ce système d’expression de protéines, pour les plus simples comme pour les plus difficiles. Dans ce dernier cas, Synthelis exploite les avantages du cell-free pour incorporer des liposomes dans le milieu d’expression et ainsi obtenir des protéoliposomes dans lesquels une protéine membranaire d’intérêt est directement intégrée dans une bicouche lipidique. Sur cette approche brevetée*, Synthelis bénéficie de droits exclusifs à échelle mondiale.
Ainsi pour l’un de ses clients, Synthelis a récemment produit et purifié 10 mg de protéines correctement repliées en 2 jours pour des applications de biologie structurale !
L’extrait cellulaire peut être préparé à l’avance et conservé jusqu’à un an !
En conclusion, les temps de production raccourcis font du système cell-free une plateforme de production de protéines :
• Puissante et performante notamment pour l’expression de protéines à haut débit (Casteleijn et al. 2013),
• Pour accélérer le développement d’un produit ou,
• A des fins de médecine personnalisée (Kanter et al. 2007).
En effet, dans ce dernier cas, le système cell-free a l’avantage, d’être plus rapide que les systèmes conventionnels, car en plus de temps de production réduit, le développement de lignées d’expression n’est pas nécessaire. Il est ainsi possible de tirer parti de la technologie acellulaire pour produire rapidement et en petites quantités des protéines propres à chaque profil de patient.
La preuve de concept d’un tel procédé est exemplifiée par les travaux de Timm et al, qui ont mis au point un modèle de bioréacteur micro-fluidique pour la production cell-free de protéines thérapeutiques à dose unique, utilisant un modèle de fabrication distribuée (Timm et al. 2016).
*Synthelis a renouvelé sa licence exclusive mondiale, issue d’un brevet basé sur un système cell-free, qui permet d’exprimer des protéines membranaires en présence de liposomes. Numéro de brevet Européen : 2 140 015, délivré le 4 avril 2018 par le “European Patent Office (EPO) » et validé pour l’Allemagne, la Belgique, la France, Le Royaume Uni, la Suisse et le Liechtenstein. Ainsi que pour les Etast-Unis, le Japon et l’Australie: UGA patent N°FR0754701, US9, 206456, JP5421241, AUST 2008263765.
Cycle en système cellulaire VS. acellulaire
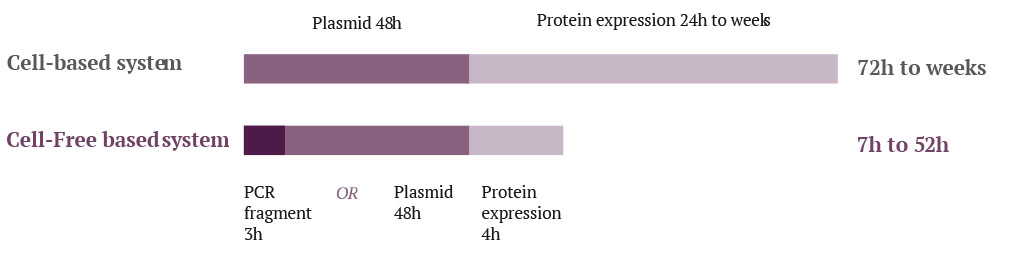
Schéma inspiré de : Henrike Niederholtmeyer, Zachary Z Sun, Yutaka Hori, Enoch Yeung, Amanda Verpoorte, Richard M Murray, Sebastian J Maerkl, 2015. Rapid cell-free forward engineering of novel genetic ring oscillators. eLife ;4:e09771
Authors & sources
Carlson E.D., Gan R., Hodgman C.E., Jewett M.C. 2012. Cell-free protein synthesis: Applications come of age. Biotechnology Advances 30:1185–1194.
Casteleijn M.G., Urtti A., Sarkhel S. 2013. Expression without boundaries: cell- free protein synthesis in pharmaceutical research. International Journal of Pharmaceutics 440:39-47.
Kanter G., Yang J., Voloshin A., Levy S., Swartz J.R., Levy R. 2007. Cell-free production of scFv fusion proteins: an efficient approach for personalized lymphoma vaccines. Blood 109(8):3393-3399.
Rosenblum G. and Cooperman, B.S. 2014. Engine out of the chassis: Cell-free protein synthesis and its uses. FEBS Letters 588:261–268.
Timm AC, Shankles PG, Foster CM, Doktycz MJ, Retterer ST: Toward microfluidic reactors for cell-free protein synthesis at the point-of-care. Small 2016, 12:810-817.
Zawada J.F, Yin G., Steiner A.R., Yang J., Naresh A., Roy S.M., Gold D.S., Heinsohn
H.G., Murray C.J. 2011. Microscale to manufacturing scale-up of cell-free cytokine production – A new approach for shortening protein production development timelines. Biotechnology and bioengineering 108(7):1570-1578.



