Technologies
Cell-Free.
Nous sommes biodesigners de protéines
La technologie de production de protéines en système « acellulaire » consiste à utiliser un extrait cellulaire (ou lysat) contenant toute la machinerie naturelle de transcription et de traduction, pour produire, in-vitro (dans un tube, une flasque, un bioréacteur…), une ou des biomolécules d’intérêt pour l’industrie pharmaceutique, le secteur du diagnostic, de la biologie de synthèse, de l’industrie agroalimentaire et plus largement de la bioéconomie.
Avec cette technologie, le système de production n’est pas basé sur la multiplication de cellules génétiquement modifiées, mais sur l’utilisation in-vitro des composants extraits du cytoplasme des cellules, donc des éléments naturellement présents dans toute cellule.
En procédant ainsi, la machinerie est dédiée à une, ou quelques, protéines d’intérêt, ce qui permet, dans la majorité des cas, d’augmenter drastiquement les rendements de production, ce qui est un avantage parmi d’autres de la technologie.
Principe général de la technologie Cell-Free
ÉTAPE 1 – PREPARATION DU MELANGE REACTIONNEL

ÉTAPE 2 – EXPRESSION DES PROTÉINES
Les principaux avantages des systèmes acellulaires
La production de protéines difficiles : protéines membranaires, protéines cytotoxiques, protéines instables, protéines non naturelles…
Une forte amélioration des rendements d’expression.
L’obtention de protéines correctement conformées et fonctionnelles, par l’ajout de chaperonnes, cofacteurs… rendu possible par le caractère ouvert du système.
Un raccourcissement du temps de production : quelques heures versus semaine(s) pour les systèmes cellulaires.
L’insertion site spécifique d’acides aminés non canoniques.
Le marquage facilité et plus homogène des protéines.
La réduction de la variabilité inter-lots.
Une grande flexibilité d’utilisation : de la microplaque à la centaine de litres.
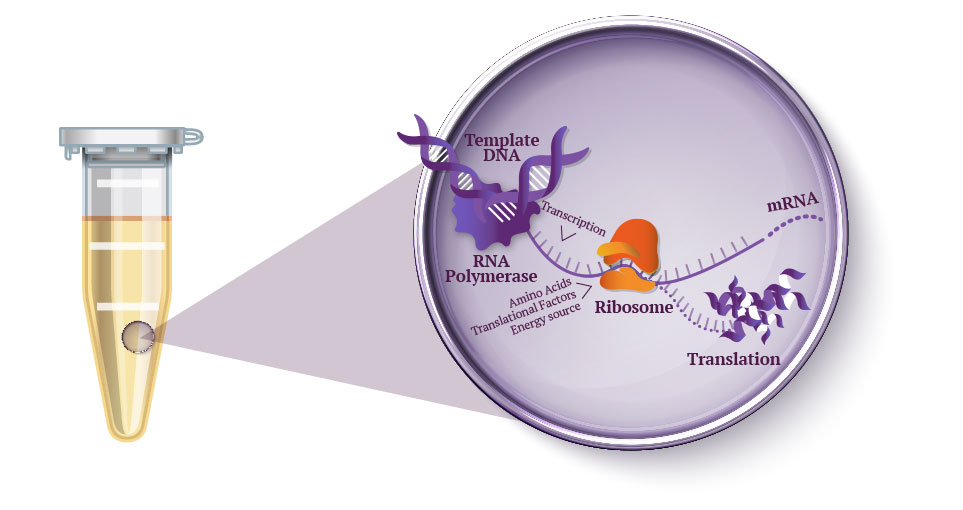
Schéma d’un système Cell-Free
L’extrait cellulaire est la base du système. Il est supplémenté par les composés nécessaires à l’expression d’un gène en une protéine : matrice ADN, nucléotides sous forme de Nucléotides Triphosphates (NTPs), source d’énergie carbonée, ARNt, 20 acides aminés… Le système étant ouvert, tout additif et cofacteur aidant à l’expression et à la structuration de la protéine peut être ajouté.


Les différents systèmes acellulaires
Les systèmes basés sur des lysats procaryotes
Ces systèmes sont les plus utilisés car ils permettent d’obtenir les meilleures productivités d’expression (plusieurs mg/mL pour certaines protéines) aux coûts les plus bas. Ils sont également plus faciles à mettre en œuvre. Leur principale limitation est de ne pas réaliser de modifications post-traductionnelles (glycosylation, phosphorylation…) à l’exception de l’établissement de ponts disulfures. Ces dernières peuvent toutefois être réalisées par l’incorporation d’acides aminés portant ces modifications ou en post-production par des couplages chimiques.
Les systèmes utilisant des lysats eucaryotes
Un nombre grandissant de systèmes acellulaires basés sur des lysats eucaryotes ont été développés ces dernières années afin de produire des protéines complexes. Ils présentent l’avantage de réaliser des modifications post-traductionnelles souvent nécessaires à l’activité des protéines d’intérêt pharmaceutique. La diversité des systèmes eucaryotes développés pour l’expression acellulaire permet de tester et sélectionner celui qui est le mieux adapté à une production de grande qualité de la protéine d’intérêt. Le point faible de ces systèmes reste pour l’instant leurs rendements d’expression qui sont inférieurs aux systèmes cellulaires et à l’acellulaire procaryote pour beaucoup de protéines.
Le système acellulaire reconstitué
Ce système est commercialisé sous le terme de « PURE system ». Sa base n’est pas constituée d’un extrait cellulaire, mais de l’assemblage des 36 protéines nécessaires aux étapes de transcription d’un gène en ARNm puis de traduction de cet ARNm en protéine. Ce système présente l’avantage d’obtenir un produit assez pur avant toute étape de purification. Il permet également de précisément moduler les ratios des différents composants de la machinerie de production et mieux comprendre leur influence respective. Ce système est un peu l’ « horlogerie fine » des technologies acellulaires. Il est utilisé pour des expressions à petite échelle car il reste coûteux et offre des rendements souvent peu élevés.
Des systèmes acellulaires peuvent ainsi être développés à partir de quasiment tout type cellulaire.
Domaines d’application

Domaine
Biomédicaments

Domaine
Biologie de synthèse

Domaine
Bioproduction

Domaine
Biologie structurale

Domaine
Bioéconomie

Domaine
Bioproduction au "pied du patient"
10 biomythes
sur les systèmes
Cell-Free
auxquels vous avez probablement toujours cru

