Le futur
de la production
est bio.
Les domaines d’applications du Cell-Free
La bioproduction consiste principalement à synthétiser des produits biologiques en multipliant des cellules qui incorporent les éléments nécessaires à la production de protéines et d’autres molécules spécifiques, permettant ainsi la production en masse de biomolécules d’intérêt.
Applications
Elle comprend la synthèse d’antibiotiques, d’anticorps monoclonaux, de vaccins, d’enzymes, de protéines humaines modifiées, de facteurs de croissance et de vecteurs viraux, pour le traitement de diverses maladies, pour lesquelles ces produits ont une spécificité et une efficacité élevées, associées à des effets secondaires moindres.
En outre, les produits naturels bioactifs (PNB) peuvent également être bioproduits. Les PNB sont des composés naturellement synthétisés par les animaux, les plantes ou les micro-organismes, qui peuvent agir comme des éléments constitutifs, des coenzymes, des facteurs de défense de l’hôte, des médiateurs de l’expression génétique, de la signalisation cellulaire ou de l’homéostasie. Ils ont été utilisés comme produits pharmaceutiques, nutraceutiques, agrochimiques et cosmétiques.
Parmi eux, on peut citer les antinéoplasiques (paclitaxel), les agents antitumoraux (mithramycine), les immunosuppresseurs (rapamycine) et les antiparasitaires (ivermectine). Compte tenu de la forte demande mondiale pour ces molécules, leur obtention à partir de sources naturelles n’est pas viable en raison de leur disponibilité limitée, des méthodes d’extraction et d’isolement complexes et coûteuses, et des faibles rendements. D’autre part, leur synthèse chimique en laboratoire peut également être problématique en raison de coût élevé de production et de stéréochimie complexe. L’utilisation de cultures cellulaires in vitro pour synthétiser les biomolécules permet d’augmenter les rendements et de réduire les coûts de production [1].
Technologie
Les molécules thérapeutiques sont fabriquées à partir d’organismes vivants tels que des animaux, des plantes, des micro-organismes et/ou par des méthodes biotechnologiques, y compris les techniques de recombinaison de l’ADN et les extraits cellulaires. Les cellules de mammifères non humains sont couramment utilisées à l’échelle industrielle, bien que certaines lignées cellulaires humaines puissent être utilisées in vitro.
En outre, les systèmes acellulaires basés sur l’utilisation de lysats cellulaires deviennent une alternative importante aux systèmes cellulaires pour la synthèse de diverses biomolécules thérapeutiques, car ils offrent plusieurs avantages distincts, tels que la possibilité de produire des protéines qu’il serait difficile ou impossible d’obtenir dans des systèmes vivants, en raison de leur cytotoxicité ou de leurs caractéristiques structurelles particulières.
Enjeux et tendances
Au cours des 30 dernières années, des investissements et des progrès considérables ont été réalisés dans les technologies de bioproduction (graphique 1) et divers produits biopharmaceutiques ont été lancés sur le marché. La bioproduction d’anticorps monoclonaux, par exemple, a déjà atteint un point de maturité. En outre, les rendements moyens obtenus par les processus de fabrication à l’échelle commerciale avec des systèmes mammifères se situent dans une fourchette de 70 à 80 %. Les technologies de traitement en aval (y compris la purification) sont devenues plus efficaces, permettant des volumes globaux plus petits et des approches à usage unique. Il est désormais plus facile et plus rapide d’établir des lignées cellulaires stables et des banques de cellules. Néanmoins, la bioproduction de certaines thérapies cellulaires et géniques doit encore être améliorée pour atteindre sa pleine maturité.
Pour l’avenir proche, les tendances en matière de bioproduction comprennent :
. les développements technologiques, tels que les systèmes de biotraitement à usage unique et les modes d’opération de biotraitement en continu ;
. le développement de nouvelles thérapies géniques et cellulaires ;
. et la mise en œuvre ou l’utilisation accrue de l’intelligence artificielle et de l’analyse des données massives (big data analytics).
Les innovations technologiques visent à accroître l’automatisation, ce qui permettra de maximiser la bioproduction et de minimiser les contraintes de capacité. Les systèmes de biotraitement à usage unique permettent de réduire le risque de contamination croisée, d’accroître la flexibilité de la production et de permettre une installation plus rapide, améliorant ainsi l’efficacité et la rentabilité de la bioproduction. La biotransformation en continu permet une production ininterrompue, réduit la variabilité d’un lot à l’autre, améliore la cohérence du produit et réduit les coûts de production [2]. Des méthodes de production innovantes sont nécessaires pour répondre aux exigences de la production de thérapies géniques et cellulaires, à savoir un contrôle strict de la qualité et des techniques de fabrication spécialisées [3]. L’intelligence artificielle peut optimiser les bioprocédés, prédire les défaillances potentielles et analyser de vastes ensembles de données, ce qui permet une production plus efficace et plus cohérente. Les modèles d’apprentissage automatique peuvent contribuer à la découverte de nouveaux médicaments et à l’ingénierie des protéines, et les méthodologies fondées sur les données permettent de gagner du temps et d’économiser des ressources dans la bioproduction [4].
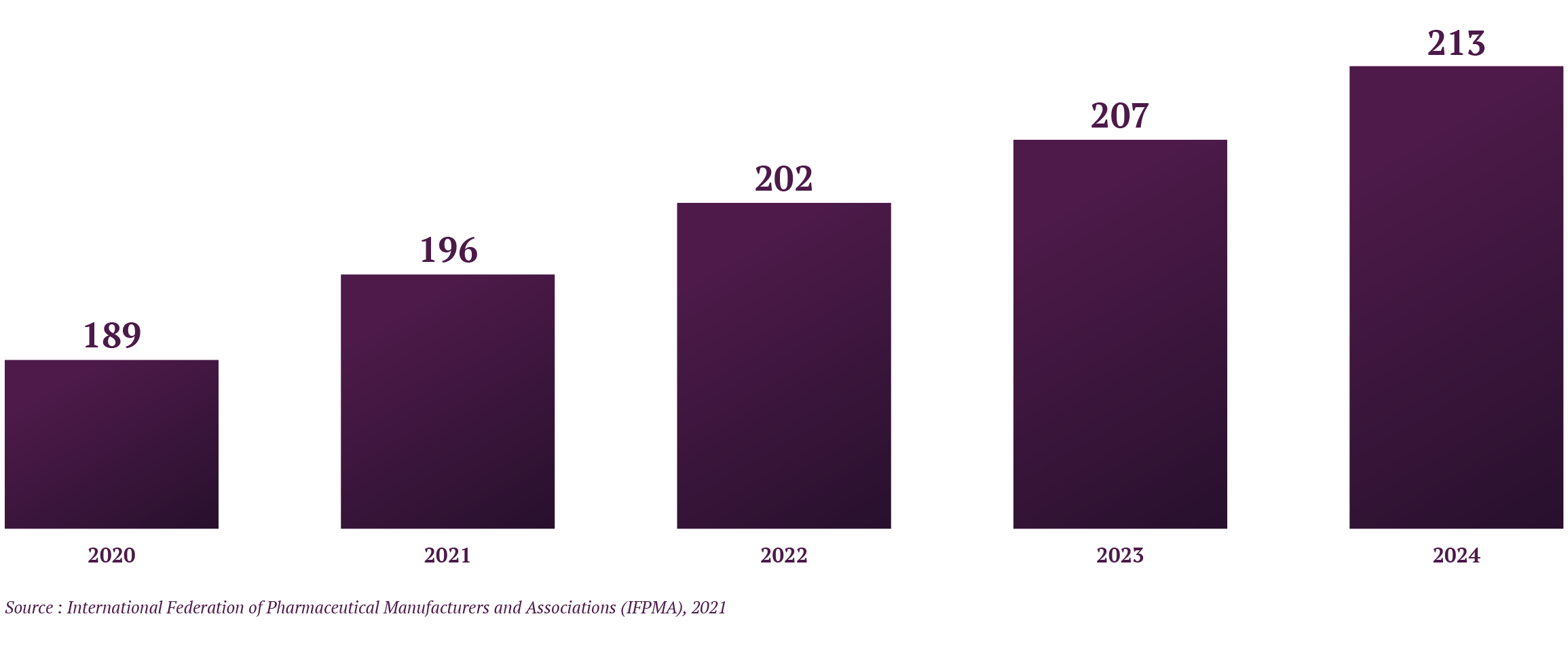
Graphique 1 : Estimation des dépenses en R&D biopharmaceutiques (en milliard de $), Global, 2020-2024
Systèmes acellulaires et bioproduction
Bien que la bioproduction soit basée sur l’utilisation de cellules pour synthétiser des biomolécules pertinentes, les systèmes acellulaires peuvent également être utilisés dans la bioproduction et peuvent même dépasser les performances des processus cellulaires. La synthèse protéique acellulaire est particulièrement bien adaptée à la synthèse de protéines « difficiles à exprimer » telles que les protéines cytotoxiques, mal repliées ou non solubles, qui sont courantes dans les produits biopharmaceutiques et immunobiologiques.
La nature ouverte du système permet d’ajouter ou de retirer des substrats et des produits et de surveiller la réaction en ligne, pour un meilleur contrôle du processus.
En outre, la technologie acellulaire permet d’éviter les étapes de culture cellulaire des méthodes in vivo, ce qui accélère la production et réduit les coûts. En ce qui concerne la bioproduction industrielle, la SPFC a la capacité de passer à l’échelle supérieure et inférieure et permet une production à haut débit [5,6].
Par ailleurs, elle permet une production à la demande, en fonction des besoins [7], ce qui témoigne d’une plus grande flexibilité par rapport à la bioproduction à base de cellules.
La portabilité des systèmes acellulaires et la possibilité d’utiliser des extraits cellulaires lyophilisés permettent des traitements sur le lieu de soins [8,9]. De plus, les caractéristiques attrayantes des CFPS ouvrent la possibilité de passer des processus traditionnels dépendant des hydrocarbures à une bioproduction plus durable de molécules chimiques et biologiques. Elle représente également une alternative avantageuse dans les situations où les chaînes d’approvisionnement traditionnelles sont compromises par des pandémies mondiales, des catastrophes naturelles ou des conflits [10]. La CFPS a déjà été utilisée pour la bioproduction de produits biopharmaceutiques, immunobiologiques et naturels bioactifs.
Written by Luísa Silva, PhD and scientific writer.
Publications
Références
Nous attendons
vos questions
avec impatience
Même
une protéine
a besoin
d’exprimer
son potentiel.
Cell-Free Systems Applications
