Le futur
de la santé
est bio.
Les domaines d’applications du Cell-Free
La bioproduction « au pied du patient » consiste à mettre au point des plateformes portables, entièrement intégrées et fermées qui incorporent des matériaux biologiques tels que des cellules de levure, des bactéries ou des lysats cellulaires, utilisés pour la bioproduction de produits spécifiques tels que des protéines thérapeutiques, des interférons, des hormones recombinantes et des vaccins au point d’intervention.
Cette bioproduction au « pied du patient » présente l’avantage de permettre la production de produits biologiques en peu de temps et avec un dispositif léger, ce qui permet de traiter les patients à l’aide de produits biologiques dans des endroits éloignés, sur des champs de bataille, dans des situations d’urgence ou dans des régions sous-développées où les infrastructures sont insuffisantes.
Fonctionnement
Les composants de base des dispositifs de bioproduction au « point d’utilisation » sont :
. un système d’expression biologique conçu pour exprimer le produit biothérapeutique en réponse à des signaux programmables et
. une plate-forme microfluidique intégrée capable de contrôler le processus de bioproduction de manière rapide et flexible, permettant des opérations portables.
Le système de bioproduction peut être conçu de manière à produire simultanément plus d’un produit biologique, à condition qu’ils soient compatibles entre eux et que des méthodes de purification soient intégrées. En outre, si des extraits acellulaires sont utilisés, ils peuvent être stockés sous forme lyophilisée et réhydratés avec de l’eau, puis incubés en utilisant la chaleur du corps pour activer les composants de l’extrait, ce qui témoigne de la remarquable portabilité de tels systèmes.
Passer à la bioproduction « au pied du patient »
La bioproduction centralisée dans des installations hautement spécialisées a été le modèle dominant pour la production de bioproduits. Toutefois, ce modèle impose des limites en termes d’accessibilité et d’évolutivité, représentant un goulot d’étranglement qui peine à répondre à la demande croissante de biothérapies. Récemment, la pandémie de COVID-19 a mis en évidence le besoin de cadres agiles de biofabrication et de distribution pour fournir des produits biologiques et biopharmaceutiques dans le monde entier.
La bioproduction « au pied du patient », rendue possible par les récents développements technologiques, peut aider à surmonter ces limitations. La production de thérapies géniques et cellulaires autologues en est un exemple : les cellules du patient doivent être transportées jusqu’au lieu de production, traitées et renvoyées au patient, ce qui peut prendre des semaines. Le passage à la bioproduction « au pied du patient » permet de réduire le temps nécessaire pour mettre le traitement à la disposition du patient et la complexité de la logistique, ce qui accroît l’accessibilité et le caractère abordable des traitements [1].
Une puce microfluidique capable de produire des doses cliniques de cellules CAR-T pour le traitement du cancer a récemment été mise au point [2]. Ce système ultra-compact (de la taille d’un jeu de cartes), automatisé et fermé, représente la première utilisation d’un microbioréacteur pour la thérapie cellulaire autologue et permet de produire des cellules CAR-T avec la même efficacité que les méthodes traditionnelles à moindre coût. La puce microfluidique développée a permis de réduire le temps de production de 30 à 40 %, et le petit nombre de cellules de départ nécessaires, comparé aux grandes plateformes de fabrication automatisées existantes, a permis de réduire les quantités de billes d’isolation, de réactifs d’activation et de vecteurs nécessaires par cycle de production, ainsi que le volume de culture cellulaire (2 ml). Outre la réduction du coût des réactifs, cette proposition est également bénéfique pour les patients en services pédiatriques dont le nombre de cellules T est faible ou insuffisant pour produire des doses thérapeutiques de cellules CAR-T.
Enjeux
L’Agence Européenne des Médicaments (EMA) et la Food and Drug Administration (FDA) considèrent que l’émergence de la bioproduction « au pied du patient » est essentiel [3,4], même si l’on suppose que ce processus prendra du temps. La bioproduction classique a souvent été suffisante mais, progressivement, la nécessité de remplacer les lignes de production existantes et de procéder à une fabrication locale ouvrira des possibilités de passer à la production « au pied du patient ». Un autre défi consiste à garantir une qualité constante des produits fabriqués par ces systèmes.
Les salles blanches portables préfabriquées et les processus automatisés permettront de normaliser les équipements et les processus, et la technologie numérique permettra de connecter les données et les systèmes de qualité de différents sites [5].
En outre, la réduction de l’échelle du traitement en amont et des opérations unitaires en aval réalisées dans les bioprocédés traditionnels, telles que la purification du bioproduit synthétisé, peut poser certaines difficultés dans le cadre de la bioproduction « au pied du patient » [6].
Systèmes acellulaires et bioproduction « au pied du patient »
Pour relever le défi de la réduction de l’échelle du traitement en amont dans la bioproduction au point d’utilisation, les systèmes acellulaires peuvent remplacer efficacement le processus traditionnel de culture cellulaire. Dans la synthèse acellulaire, une solution lyophilisée contenant des composants cellulaires est utilisée dans le bioréacteur, ainsi qu’un plasmide contenant la séquence de la protéine cible [6].
Un exemple réussi d’utilisation de systèmes acellulaires dans la bioproduction POC est le système Bio-MOD, qui utilise une méthode acellulaire pour la fabrication continue de bout en bout de substances médicamenteuses biologiques [7]. Le système portable (de la taille d’une valise) de biotraitement sans cellules intègre le machine learning pour produire des protéines à la demande d’une pureté et d’une qualité accrues et constantes. Le système peut être mis à l’échelle pour permettre de travailler avec des volumes plus importants.
L’algorithme de machine learning extrait suffisamment de données des capteurs du processus et des mesures analytiques pour garantir la cohérence du processus. L’algorithme est également capable de détecter tout écart par rapport aux prévisions, ce qui augmente le niveau de sécurité par rapport à la méthode actuelle qui consiste à tester un produit après sa fabrication.
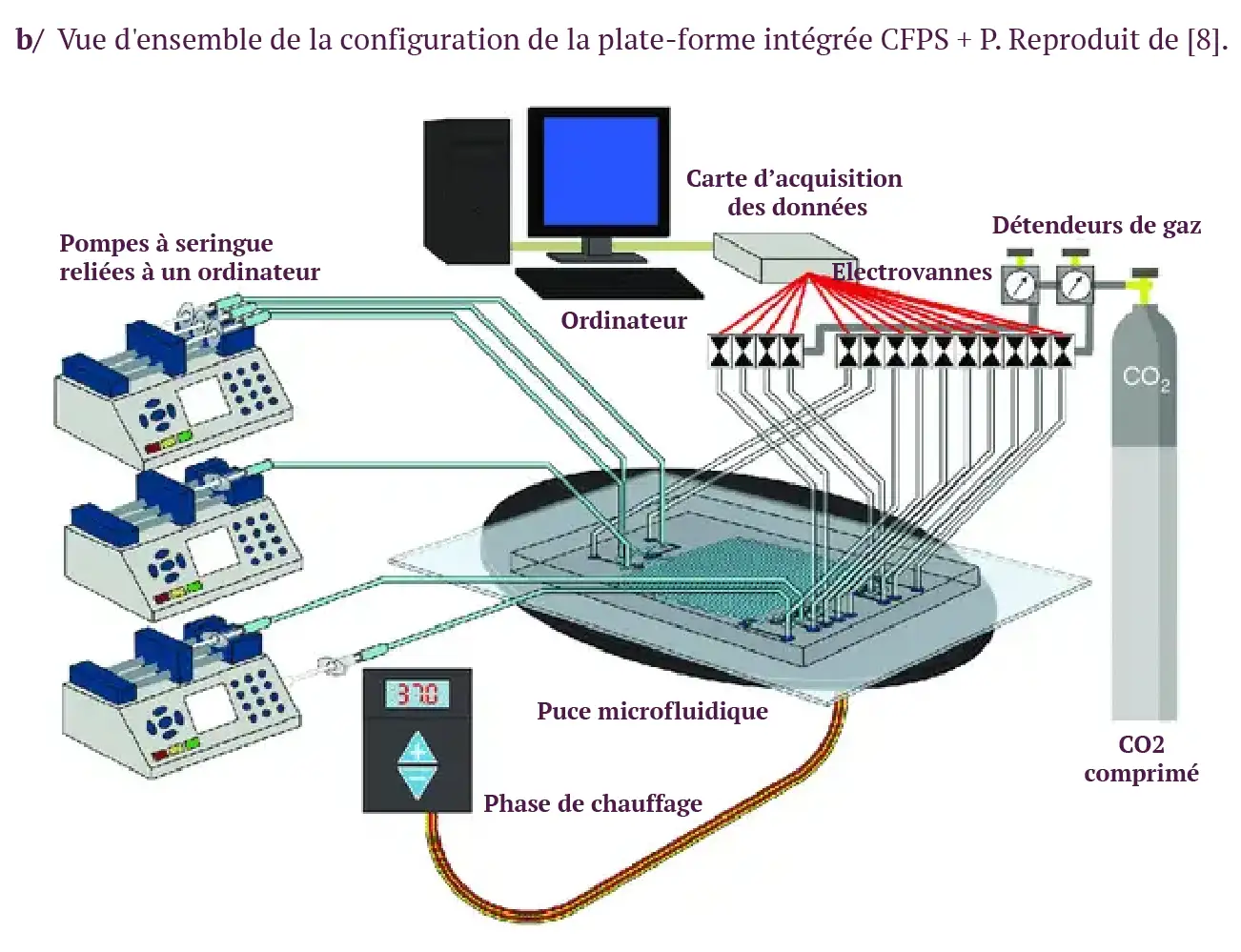
Le système a été utilisé pour produire et purifier la protéine fluorescente verte et la cecropine B avec une grande pureté et à des concentrations thérapeutiques pertinentes à un faible coût (figure 1) [8]. Les auteurs ont utilisé des matériaux frais et lyophilisés pour la synthèse acellulaire des protéines et ont appliqué l’immunoprécipitation pour une purification très efficace des protéines sur la puce.
Figure 1 : Système intégré pour la synthèse et la purification de protéines acellulaires

Publications
Références
En savoir plus

Nature communications
Synthetic biology and microbioreactor platforms for programmable production of biologics at the point-of-care

Sciences Advances
On-demand biomanufacturing of protective conjugate vaccines
Nous attendons
vos questions
avec impatience
Même
une protéine
a besoin
d’exprimer
son potentiel.
Cell-Free Systems Applications
