Le futur
de la biologie
de synthèse
est bio.
Les domaines d’applications du Cell-Free
La biologie de synthèse est un domaine scientifique à l’interface entre les sciences de la vie et l’ingénierie. Elle consiste à appliquer aux systèmes biologiques des principes d’ingénierie, notamment la standardisation, la modularité et l’abstraction. La biologie de synthèse conçoit et développe en laboratoire des systèmes biologiques n’existant pas dans la nature afin de générer des produits utiles à l’humanité et ses applications vont de la médecine à l’agriculture en passant par les procédés industriels. Grâce à l’utilisation d’ADN recombinant, la biologie de synthèse conçoit et développe en laboratoire de nouveaux systèmes biologiques qui n’existent pas dans la nature, permettant ainsi la synthèse de nouveaux produits aux applications utiles. Il permet également la production à moindre coût de molécules déjà connues ou difficilement synthétisables.
Fonctionnement
La biologie de synthèse peut modifier un organisme vivant dans le but de lui faire produire une substance particulière qui n’est pas synthétisée naturellement, ou produire un organisme vivant totalement nouveau. Cela passe par la manipulation des gènes bactériens, la création de voies métaboliques synthétiques, la modification de l’ADN pour améliorer ses propriétés et produire des protéines inédites, ainsi que l’ajout de circuits régulateurs modifiant l’activité cellulaire.
La biologie de synthèse définit des bioéléments de base encodés par l’ADN, qui sont ensuite combinés pour produire des réactions biochimiques. L’association de ces réactions forme des voies biologiques qui peuvent être regroupées au sein d’une unité cellulaire, laquelle peut elle-même faire partie d’un groupement cellulaire. La biologie de synthèse est basée sur le processus de Design- Build-Test-Learn (DBTL). Le cycle DBTL comprend la conception des bioéléments initiaux ou l’établissement d’un modèle préliminaire pour atteindre les objectifs d’ingénierie définis, la construction des bioéléments, l’évaluation de leurs résultats et la compréhension des stratégies d’ingénierie efficaces et de leurs raisons, ainsi que l’intégration des connaissances acquises dans les décisions du cycle DBTL suivant (fig. 1).
Figure 1 : Le cycle Design-Build-Test-Learn (DBTL). Reproduit de [1]
![Biologie de Synthese - Figure1 Le cycle Design-Build-Test-Learn (DBTL). Reproduit de [1]](http://synthelis.com/wp-content/uploads/2025/02/Biologie-de-Synthese-Figure1.webp)
Importance et applications
La biologie de synthèse nous permet d’améliorer notre compréhension des mécanismes biologiques. Cette technologie représente une nouvelle façon d’étudier les organismes vivants et de découvrir leur fonctionnement. Comme les systèmes synthétiques peuvent être beaucoup plus simples que leurs homologues naturels, ils permettent aux chercheurs d’effectuer des expériences impossibles à réaliser ou à interpréter. Mais le principal avantage de la biologie de synthèse réside dans sa capacité à créer de nouveaux produits à fort potentiel dans les domaines de la santé, de l’industrie et de l’environnement (figure 2).
La biologie de synthèse nous permet d’améliorer notre compréhension des mécanismes biologiques. Cette technologie représente une nouvelle façon d’étudier les organismes vivants et de découvrir leur fonctionnement. Comme les systèmes synthétiques peuvent être beaucoup plus simples que leurs homologues naturels, ils permettent aux chercheurs d’effectuer des expériences impossibles à réaliser ou à interpréter. Mais le principal avantage de la biologie de synthèse réside dans sa capacité à créer de nouveaux produits à fort potentiel dans les domaines de la santé, de l’industrie et de l’environnement (figure 2).
Figure 2 : Schéma de la biologie de synthèse et ses domaines d’application. Reproduite à partir de [2]
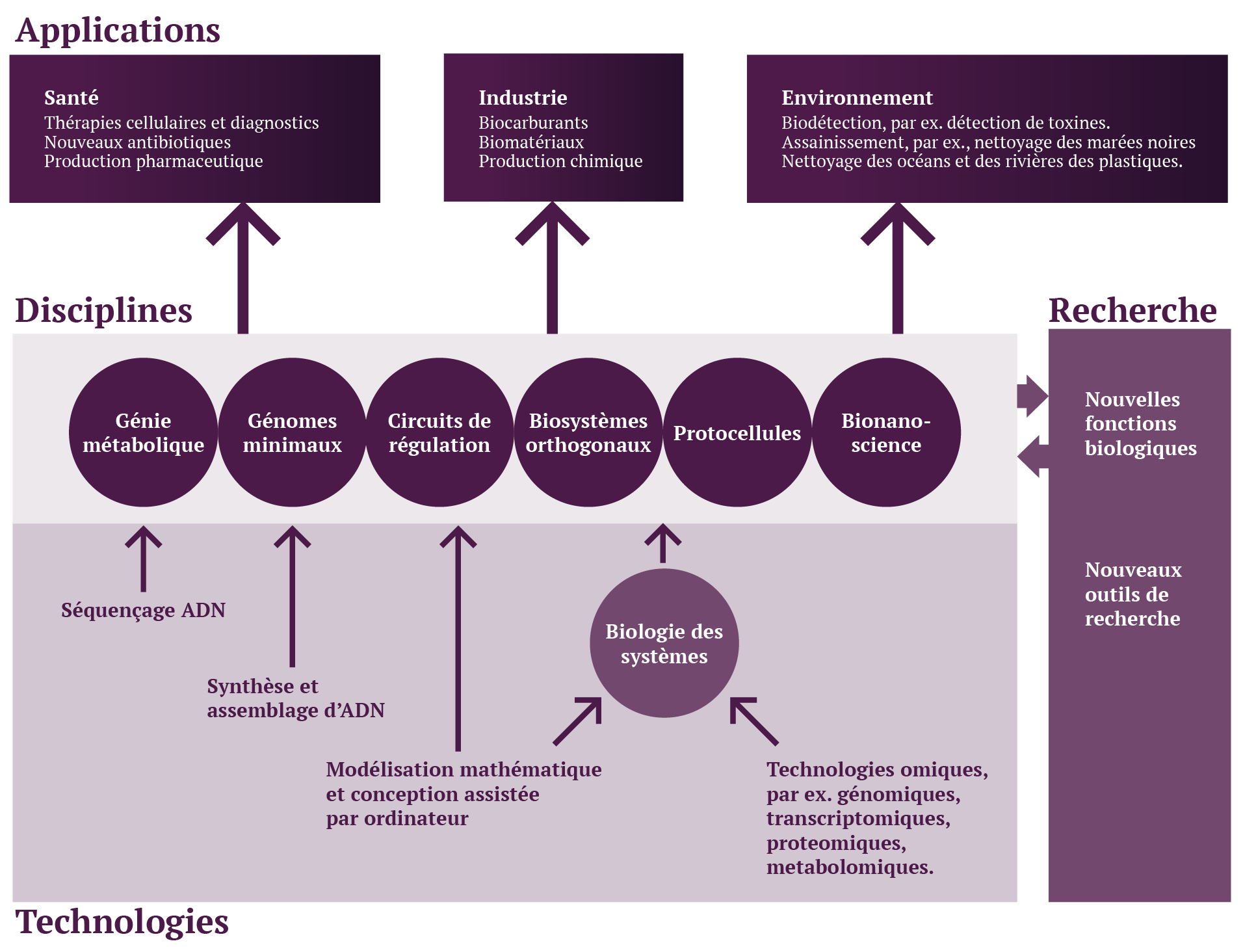
Dans les secteurs médicaux et pharmaceutiques, la biologie de synthèse permet la production de nouveaux médicaments, vaccins, diagnostics innovants et de nouveaux tissus biologiques. Par exemple, le taxol, un anticancéreux, est produit par Saccharomyces cerevisiae grâce à la biologie de synthèse avec des rendements supérieurs à ceux obtenus naturellement [3]. De plus, la production d’acide artémisinique, précurseur de l’artémisinine (un médicament antipaludique), par des cellules de levure modifiées ou des cellules d’Escherichia coli, permet une réduction des coûts de production d’environ 90 % par rapport au médicament traditionnellement obtenu à partir de la plante Artemisia annua [4].
Dans le secteur chimique, la biologie de synthèse permet de produire des composés difficiles ou coûteux à produire. L’isobutène en est un exemple, servant de précurseur pour la fabrication de matières plastiques, de caoutchoucs, de lubrifiants et de carburants. Il peut désormais être produit par une voie métabolique créée par la biologie de synthèse à partir de ressources renouvelables telles que les déchets agricoles et forestiers, l’amidon, la canne à sucre ou la betterave [5].
Dans le secteur de l’énergie, les micro-organismes peuvent être transformés pour produire de l’hydrogène ou réaliser une photosynthèse artificielle, ou encore décomposer la biomasse pour produire de l’énergie, alternative aux combustibles fossiles [6].
Dans le domaine de l’environnement, la biologie de synthèse peut aider à détecter les polluants, à les dégrader ou à les éliminer grâce à l’utilisation de biocapteurs [7].
En agriculture, de nouveaux additifs alimentaires peuvent être développés à l’aide de la biologie de synthèse. De plus, elle permet l’utilisation de cultures plus adaptées et résilientes ou sans agents allergènes ou encore, la conception de nouveaux pesticides plus respectueux de l’environnement et de la santé. [8]
Tendances et enjeux
À l’avenir, la biologie de synthèse continuera d’explorer le génie métabolique, créant de nouvelles voies métaboliques de synthèse pour produire des composés qui ne peuvent être synthétisés naturellement par les organismes vivants, notamment de nouveaux médicaments et de nouveaux biocarburants. Une autre stratégie pour synthétiser de nouveaux produits par les systèmes cellulaires reposera sur la création de nouveaux circuits internes capables de modifier le modèle d’activité cellulaire. Il sera possible de créer de nouveaux réseaux génétiques artificiels qui, une fois introduits dans des cellules appropriées, pourront être utilisés pour détecter et corriger des altérations métaboliques, comme celles observées dans le diabète, par exemple.
Des avancées en bioremédiation et biodégradation sont également attendues afin d’améliorer la gestion des déchets et la lutte contre la pollution environnementale. De plus, des progrès en ingénierie du microbiome devraient voir le jour pour répondre à des enjeux environnementaux ou agricoles, comme la conception de bactéries capables de fixer l’azote afin de remplacer les engrais chimiques, ou la modification génétique de plantes pour induire une résistance aux maladies ou améliorer leur composition nutritionnelle. Enfin, des avancées dans le perfectionnement des systèmes de délivrance et des nouvelles approches chimiques pour modifier les organismes sont également attendues, notamment via l’utilisation de virus modifiés, de nanoparticules, de nanotubes d’ADN ou encore de protéines modifiées.
Les attentes sont élevées, notamment en ce qui concerne la production de nouveaux médicaments et de biocarburants. Néanmoins, et malgré les améliorations observées, le domaine n’a pas atteint sa pleine maturité et dépend de développements ultérieurs dans les outils de génie génétique. En outre, il est difficile de normaliser les systèmes biologiques complexes et les circuits d’ingénierie peuvent ne pas fonctionner de la même manière dans différents systèmes, ce qui nécessite une optimisation des paramètres. De plus, les cellules ont un pool limité de ressources nécessaires aux processus biologiques et l’ajout d’un bioélément synthétique représente une charge supplémentaire sur les activités de la cellule, entraînant des taux de croissance plus lents et des taux de synthèse protéique inférieurs [2].
Systèmes acellulaires et biologie de synthèse
La synthèse de protéines en système acellulaire répond efficacement aux défis actuels de la biologie synthétique. Bien que E. coli ait été utilisé comme modèle cellulaire en biologie de synthèse depuis ses débuts, fournissant le matériel nécessaire pour faire fonctionner le système de synthèse, il peut être difficile à contrôler et des réactions secondaires inattendues peuvent se produire.
Des méthodes acellulaires ont été appliquées en biologie de synthèse, en combinant les composants cellulaires nécessaires pour piloter le système. Ces composants peuvent se présenter sous forme d’extraits bruts ou de protéines purifiées, produites à partir de bactéries ou dans un système acellulaire. Le retrait de la membrane cellulaire permet l’accès direct à l’espace interne de la cellule et, ainsi, un substrat requis pour une réaction peut être facilement ajouté au tube à essai et les produits de réaction peuvent également être facilement retirés et purifiés. L’état du système peut être surveillé et échantillonné rapidement. De plus, un système acellulaire peut monter en échelle pour permettre la production industrielle.
Des publications récentes démontrent le potentiel de l’association de systèmes acellulaires à des processus de biologie de synthèse [9,10].
Publications
Références
En savoir plus

CNRS - Le journal
L'ABC de la biologie de synthèse

Ministère de l'Économie
Biologie de synthèse - Réalisations

INRAE - (pdf)
Avis du comité d'éthique sur la biologie de synthèse

Sénat - France
Les enjeux de la biologie de synthèse

SCNAT - Académie des sciences naturelles
Qu’est-ce que la biologie synthétique?
Nous attendons
vos questions
avec impatience
Même
une protéine
a besoin
d’exprimer
son potentiel.
Cell-Free Systems Applications
