Le futur
de la biologie
structurale
est bio.
Les domaines d’applications du Cell-Free
Les fonctions des macromolécules au sein des cellules sont intimement liées et dépendent de leur structure tridimensionnelle (structure tertiaire) qui, à son tour, dépend de leur composition de base (structure primaire). La biologie structurale étudie la structure des molécules et des macromolécules, la façon dont elles se replient et la manière dont les modifications structurelles et les mauvais repliements peuvent affecter leurs fonctions cellulaires.
En étudiant la structure des molécules, il est possible de comprendre comment elles fonctionnent. La comparaison de leur structure physiologique et de structures mal conformées permet de mieux comprendre certaines maladies. En effet, un mauvais repliement protéique peut être à l’origine de maladies telles qu’Alzheimer, Parkinson ou la fibrose kystique. Les connaissances acquises grâce à la biologie structurale sont une aide précieuse pour le développement de nouveaux traitements.
Importance et applications
La biologie structurale est utilisée depuis de nombreuses années. Elle a notamment permis de déterminer en 1953 la structure de l’ADN grâce à la diffraction aux rayons X. Et plus récemment la résolution de la structure de la protéine Spike du virus SARS-CoV2 permet de mieux comprendre le mécanisme de fusion du virus et d’étudier les interactions qui sont mises en jeu par les anticorps neutralisants lors de l’infection ou de la vaccination.
Ce domaine en constante évolution permet aujourd’hui de résoudre des structures de plus en plus précises, d’étudier des complexes moléculaires de plus en plus volumineux et d’étudier des processus qui se produisent en moins d’un dixième de trillion de seconde. Les modèles informatiques, complémentaires des méthodes de résolution de structures, permettent de concevoir de nouvelles protéines que l’on ne trouve pas dans la nature. Ces nouvelles protéines aux fonctions utiles peuvent constituer des médicaments potentiels.
Les informations recueillies grâce à la biologie structurale trouvent des applications en médecine, en biotechnologie et en agriculture.
Fonctionnement
Les analyses de biologie structurale sont réalisées à l’aide de techniques d’imagerie telles que la cryo-microscopie électronique (cryo-EM), la cristallographie aux rayons X, la spectroscopie de résonance magnétique nucléaire (RMN) et la diffusion des rayons X aux petits angles, ainsi que la modélisation informatique, afin de déterminer la structure tridimensionnelle des macromolécules biologiques à l’échelle atomique. Ces techniques permettent d’observer des molécules isolées mais aussi des structures plus importantes telles que les complexes moléculaires (notamment l’association de protéines et/ou d’acides nucléiques formant une unité fonctionnelle), les virus et les organites.
L’évolution de la biologie structurale comprend la fusion de toutes les techniques d’imagerie, ce qui permet de créer une carte plus précise et plus claire de la forme des macromolécules et de la manière dont elles interagissent avec d’autres.
Enjeux et Tendances
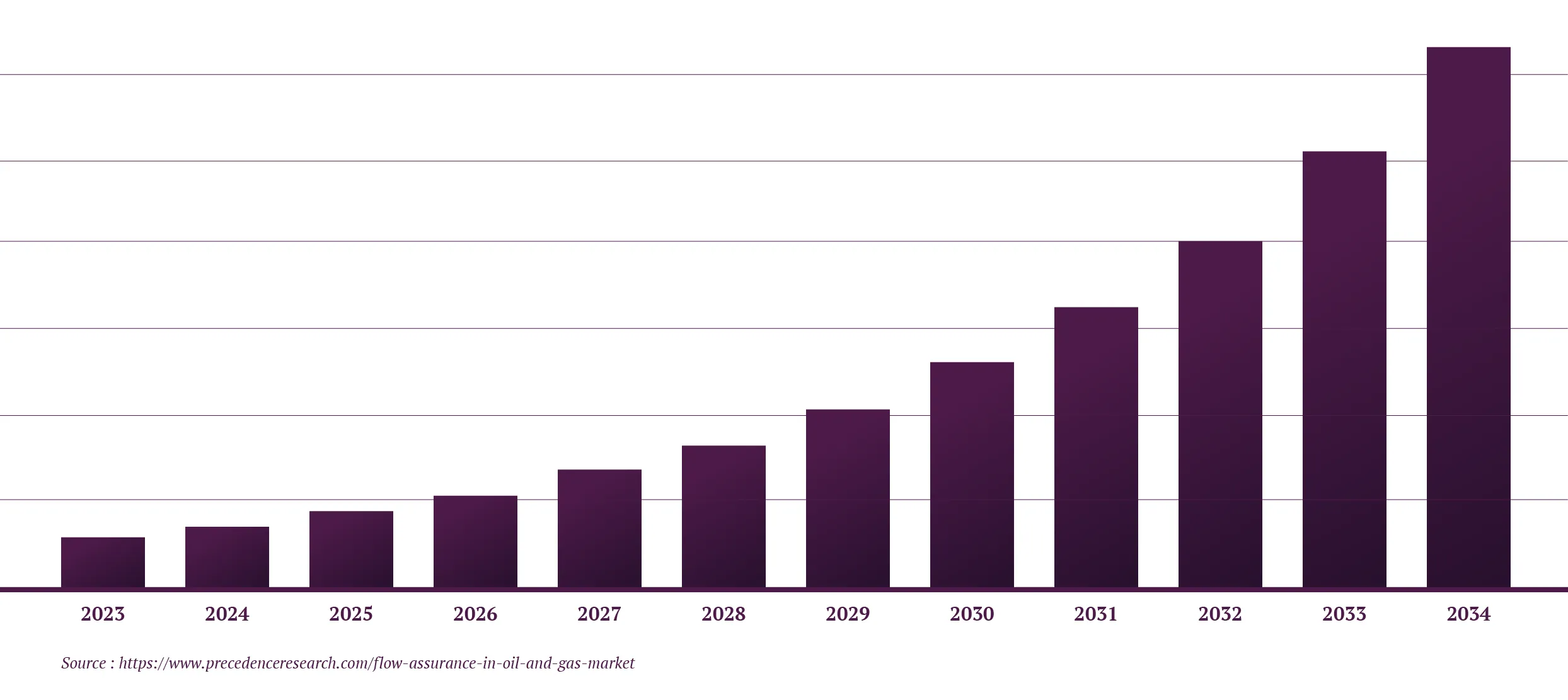
Le marché mondial de la biologie structurale connaît une expansion rapide dans le monde entier (figure 1), car elle joue un rôle central dans la compréhension de l’arrangement et du pliage complexe des protéines, des acides nucléiques, des glucides et des membranes lipidiques. Le segment du drug discovery devrait capter la plus grande part de marché.
Figure 1 – Évolution de la taille du marché de la biologie structurale de 2023 à 2034
Une des principales difficultés de la biologie structurale est la prédiction ou la modélisation de la structure des protéines. Des approches informatiques, en parallèle avec des techniques expérimentales de détermination de structure, ont été développées pour prédire la structure 3D des macromolécules, leur dynamique et leurs interactions. Deux stratégies principales ont été employées pour y parvenir, à savoir les approches basées sur des modèles et des réseaux neuronaux (deepl learning) [1,2]. Afin de comprendre comment les macromolécules fonctionnent dans un environnement complexe natif et générer un modèle intégré multi-échelle de cellules entières, une approche de biologie structurale intégrative sera nécessaire. Rassembler les améliorations et l’expansion des ensembles de formation structurale pour améliorer la modélisation, et intégrer diverses données provenant de domaines complémentaires comme la protéomique (figure 2).
Une autre tendance croissante en biologie structurelle est l’étude des structures 4D d’entités complexes (enzymes et autres ensembles structurels spatialement et temporellement hétérogènes) tout au long d’un cycle fonctionnel, dans lequel la quatrième dimension est le temps [1,2]. Cela nécessitera de nouvelles techniques et méthodologies visant à capturer et analyser les aspects dynamiques des structures biomoléculaires lorsqu’elles répondent à différentes conditions environnementales ou au cours de processus biologiques.
Figure 2 – Biologie structurale intégrée – l’interaction entre diverses technologies. Reproduite à partir de [2]
![Biologie Structurale - Figure2 Figure 2 – Biologie structurale intégrée – l’interaction entre diverses technologies. Reproduite à partir de [2]](http://synthelis.com/wp-content/uploads/2025/02/Biologie-Structurale-Figure2.webp)
Systèmes acellulaires et biologie structurale
La synthèse de protéines en système acellulaire (CFPS) utilisant des lysats cellulaires d’Escherichia coli a été appliquée avec succès à la préparation d’échantillons de protéines pour la détermination de la structure par cristallisation aux rayons X et spectroscopie RMN. Plusieurs milligrammes de protéines peuvent être synthétisés par dialyse de la réaction acellulaire en quelques heures. Une grande variété de protéines peut ainsi être produite, y compris les protéines de mammifères, les complexes protéiques hétéromultimériques et les protéines membranaires, ce qui représente un avantage majeur sur les méthodes d’expression de protéines recombinées avec des cellules hôtes bactériennes et eucaryotes.
La synthèse acellulaire permet de repousser l’une des limites de l’analyse structurale des protéines, à savoir la production de protéines cibles à haut rendement et de haute pureté. Une méthode a été développée pour générer des protéines fonctionnelles de différentes tailles provenant de multiples organismes hôtes et sources d’ADN à l’échelle moléculaire, en utilisant un système d’expression acellulaire de protéines à base de germes de blé eucaryote [3]. Le système a été capable de produire des protéines avec un haut niveau de pureté (> 98 %) compatibles avec les trois principaux formats d’échantillons protéiques utilisés pour la biologie structurale, y compris l’analyse par particules uniques au microscope électronique et la cristallographie bidimensionnelle et tridimensionnelle des protéines. En outre, en utilisant un ribosome eucaryote, le système sans cellules permettrait la synthèse de protéines eucaryotes complexes, y compris, par exemple, des complexes protéiques et des protéines membranaires [4].
La cristallisation des protéines cellulaires est une technique qui a été avantageusement utilisée dans les études de biologie structurale puisqu’elle ne nécessite pas de purification des protéines ni de processus de cristallisation compliqué.
Néanmoins, seules quelques structures de protéines ont été déterminées jusqu’à présent puisque les cristaux sont formés accidentellement dans des cellules vivantes et sont de taille et de qualité insuffisantes pour l’analyse de structure.
Récemment, il a été rapporté l’application de CFPS à la cristallisation des protéines dans les cellules pour la synthèse du cristal polyédrique, l’un des cristaux de protéines dans les cellules les plus étudiés [5]. La méthode dite de cristallisation des protéines libres de cellules (CFPC) impliquait une cristallisation directe des protéines à l’aide d’un système acellulaire et était capable d’effectuer la cristallisation et la détermination de la structure de cristaux polyédraux de taille nanométrique à haute résolution. Le CFPC s’est concentré sur :
. l’établissement de la cristallisation des protéines en utilisant le CFPS avec des réactions rapides et à petite échelle et
. la manipulation de la cristallisation par ajout de réactifs chimiques. L’avantage de l’utilisation du CFPC est que divers réactifs peuvent être ajoutés au mélange réactionnel sans empêcher la synthèse des protéines. Ainsi, le CFPC ouvre la possibilité de cristalliser des protéines instables et de déterminer rapidement leurs structures.
Publications
Références
En savoir plus

Nature
Structures et distributions des protéines Spike du SARS-CoV-2 à la surface de virions

Alzheimer's association - Richard C. Mohs,Nigel H. Greig
Drug discovery and development: Role of basic biological research
Nous attendons
vos questions
avec impatience
Même
une protéine
a besoin
d’exprimer
son potentiel.
Cell-Free Systems Applications
